Termodynamikk og varmeoverføring. Metoder for varmeoverføring og beregning. Varmeoverføring er ...
I dag vil vi prøve å finne svaret på spørsmålet"Varmeoverføring er det? ..". I artikkelen vil vi se på hva som er en prosess, hvilke typer det eksisterer i naturen, og også finne ut hva som er forholdet mellom varmeoverføring og termodynamikk.
definisjon

Varmeoverføring er en fysisk prosess, essensensom er overføring av varmeenergi. Utvekslingen foregår mellom to organer eller deres system. I dette tilfellet vil forutsetningen være overføring av varme fra de mer oppvarmede kroppene til de mindre oppvarmede.
Prosessfunksjoner
Varmeoverføring er det veldig fenomenetsom kan oppstå i direkte kontakt, og i nærvær av skillelinjer. I det første tilfellet er alt klart, i det andre kan legemer, materialer og miljøer brukes som barrierer. Varmoverføring vil oppstå i tilfeller der et system som består av to eller flere organer ikke er i en tilstand av termisk likevekt. Det vil si at en av objektene har høyere eller lavere temperatur enn den andre. Det er da overføring av termisk energi. Det er logisk å anta at det vil ende når systemet er i en tilstand av termodynamisk eller termisk likevekt. Prosessen skjer spontant, da den andre loven om termodynamikk kan fortelle oss.
typer
Varmeoverføring er en prosess som kandelt inn på tre måter. De vil ha en grunnleggende natur, siden det er mulig å skille mellom virkelige underkategorier med sine egne karakteristiske trekk sammen med generelle lover. Til dags dato er det vanlig å skille tre typer varmeoverføring. Det er termisk ledningsevne, konveksjon og stråling. La oss starte med den første, kanskje.
Varmeoverføringsmetoder. Termisk ledningsevne.

Dette er eiendommen til en bestemtmateriell kropp for å overføre energi. Samtidig overføres det fra den mer oppvarmede delen til den som er kaldere. Grunnlaget for dette fenomenet er prinsippet om den kaotiske bevegelsen av molekyler. Dette er den såkalte Brownian-bevegelsen. Jo høyere temperaturen i kroppen, desto mer er molekylene flytte inn i den, siden de har større kinetisk energi. Prosessen med varmeledning innebærer elektroner, molekyler, atomer. Det utføres i organer, hvor forskjellige deler har forskjellige temperaturer.
Hvis et stoff er i stand til å utføre varme, kan visnakk om tilstedeværelsen av kvantitative egenskaper. I dette tilfellet spilles rollen av varmeledningsevneens koeffisient. Denne egenskapen viser hvor mye varme som vil passere gjennom enhetens indikatorer på lengde og areal per tidsenhet. Samtidig endres kroppstemperaturen nøyaktig med 1 K.
Det var tidligere antatt at bytte av varme i forskjelligeorganer (inkludert varmeoverføring omslutende strukturer) på grunn av det faktum at fra en del av kroppen til en annen strømmer såkalt kalori. Men ingen har funnet tegn på sin virkelige eksistens, og da molekylær-kinetisk teori utviklet seg til et visst nivå, glemte de å tenke på kaloriinnholdet, fordi de alle ikke klarte å tenke, fordi hypotesen var uholdbar.
Konveksjon. Varmoverføringsvann

Under denne metoden for varmeenergiutvekslingOverføring av interne strømmer forstås. La oss tenke oss en vannkoker. Som det er kjent, stiger mer oppvarmede luftstrømmer til toppen. En kald, tyngre, gå ned. Så hvorfor skal vann være annerledes? Med henne er alt absolutt det samme. Og i løpet av en slik syklus vil alle lag av vann, uansett hvor mange, varmes opp før en tilstand av termisk likevekt begynner. Under visse forhold, selvfølgelig.
stråling

Denne metoden er i utgangspunktetelektromagnetisk stråling. Den oppstår på grunn av intern energi. Vi vil ikke gå inn i teorien om termisk stråling mye, vi bare merker at årsaken til dette ligger i utformingen av ladede partikler, atomer og molekyler.
Enkle oppgaver for varmeledning
La oss nå snakke om hvordan du ser i praksis.varmeoverføring beregning. La oss løse et enkelt problem relatert til mengden varme. Anta at vi har en masse vann som er lik et halv kilo. Vannets innledende temperatur er 0 grader Celsius, sluttemperaturen er 100. La oss finne hvor mye varme vi brukte for å varme denne massen av stoffet.
For dette trenger vi formelen Q = cm (t2-t1), hvor Q er mengden varme, c er den spesifikke varmen til vann, m er massen av stoffet, t1 - innledende, t2 - sluttemperatur. For vann er verdien av c tabulær. Spesifikk varmekapasitet vil være lik 4200 J / kg * C. Nå erstatter vi disse verdiene inn i formelen. Vi oppdager at mengden varme vil være 210000 J, eller 210 kJ.
Den første loven om termodynamikk

Termodynamikk og varmeoverføring er relatertnoen lover. De er basert på kunnskap om at endringer i den interne energien i systemet kan oppnås ved å bruke to metoder. Den første er utførelsen av mekanisk arbeid. Den andre er en melding om en viss mengde varme. Den første loven om termodynamikk er forresten basert på dette prinsippet. Her er dens ordlyd: Hvis en viss mengde varme ble kommunisert til systemet, vil det bli brukt på å gjøre arbeid på eksterne organer eller på å øke sin indre energi. Matematisk notasjon: dQ = dU + dA.
Fordeler eller ulemper?
Absolutt alle mengder som er inkludert imatematisk oversikt over termodynamikkens første lov, kan skrives både med et plustegn og et minustegn. Dessuten vil deres valg bli diktert av forholdene i prosessen. Anta at systemet mottar litt varme. I dette tilfellet er kroppen i den oppvarmet. Følgelig skjer gassutvidelse, noe som betyr at arbeidet blir gjort. Som et resultat vil verdiene være positive. Hvis mengden varme blir tatt bort, blir gassen avkjølt, arbeidet er gjort på det. Verdier vil ta inverse verdier.
Alternativ formulering av termodynamikkens første lov
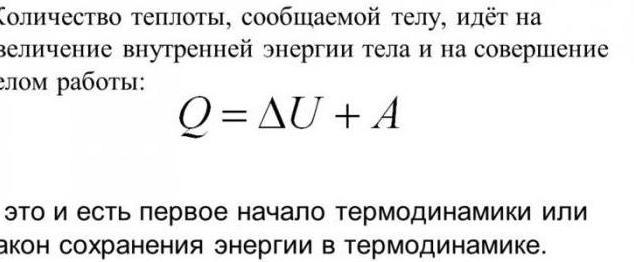
Anta at vi har noe med jevne mellomromskuespiller. I den utfører arbeidsorganet (eller systemet) en sirkulær prosess. Det kalles en syklus. Som et resultat vil systemet vende tilbake til sin opprinnelige tilstand. Det ville være logisk å anta at i dette tilfellet vil endringen i intern energi være null. Det viser seg at mengden varme vil være lik perfekt arbeid. Disse bestemmelsene tillater oss å formulere den første loven om termodynamikk på en annen måte.
Fra det kan vi forstå at det i naturen ikke kanDet er en evigvarende bevegelsesmaskin av den første typen. Det vil si en enhet som gjør mer arbeid enn energi mottatt fra utsiden. I dette tilfellet må det utføres handlinger med jevne mellomrom.
Den første loven om termodynamikk for isoprosesser
Tenk først, den isokoriske prosessen. Med det forblir volumet konstant. Så vil volumendringen være null. Følgelig vil arbeidet også være null. Vi fjerner dette begrepet fra den første loven i termodynamikken, hvoretter vi får formelen dQ = dU. Dette betyr at med isokorisk prosess går all varme som leveres til systemet for å øke den indre energien til gassen eller blandingen.
La oss nå snakke om isobarisk prosess. Konstant verdi i det forblir press. I dette tilfellet endres den interne energien parallelt med arbeidets ytelse. Her er den opprinnelige formelen: dQ = dU + pdV. Vi kan enkelt beregne arbeidet som gjøres. Det vil være lik uttrykket uR (T2-T1). Forresten, dette er den fysiske betydningen av den universelle gasskonstanten. Med en mol gass og en temperaturforskjell på en Kelvin vil den globale gasskonstanten være lik arbeidet som er gjort under isobariske prosess.








